- Müəllif Jason Gerald [email protected].
- Public 2024-02-01 14:11.
- Son dəyişdirildi 2025-01-23 12:06.
Heç bir şüşə suyu bir neçə saat isti günəşin altında qoyub açanda yüngülcə "tıslama" səsi eşitmisinizmi? Bu, buxar təzyiqi adlanan bir prinsipə bağlıdır. Kimyada buxar təzyiqi, içindəki kimyəvi maddə buxarlandıqda (qaza çevrildikdə) qapalı bir qabın divarları tərəfindən verilən təzyiqdir. Verilən bir temperaturda buxar təzyiqini tapmaq üçün Clausius-Clapeyron tənliyindən istifadə edin: ln (P1/P2) = (ΔHbuxar/R) ((1/T2) - (1/T1)).
Addım
Metod 1 /3: Clausius-Clapeyron tənliyindən istifadə
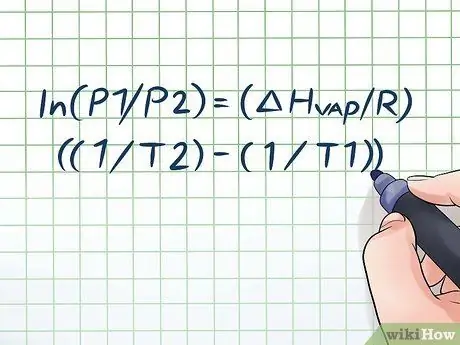
Addım 1. Clausius-Clapeyron tənliyini yazın
Zamanla buxar təzyiqinin dəyişməsi ilə buxar təzyiqini hesablamaq üçün istifadə olunan düstura Clausius -Clapeyron tənliyi deyilir (fiziklər Rudolf Clausius və Benoît Paul mil mil Clapeyronun adını daşıyır.) Bu, əsasən bir çox problemi həll etmək üçün lazım olacaq düsturdur. Buxar təzyiqi suallarına tez -tez fizika və kimya dərslərində rast gəlinir. Formul belədir: ln (P1/P2) = (ΔHbuxar/R) ((1/T2) - (1/T1)). Bu düsturda dəyişənlər təmsil olunur:
-
Hbuxar:
Bir mayenin buxarlanma entalpiyası. Bu entalpiya ümumiyyətlə kimya dərsliyinin arxasındakı cədvəldə tapıla bilər.
-
R:
Real/universal qaz sabitliyi və ya 8.314 J/(K × Mol).
-
S1:
Buxar təzyiqinin məlum olduğu temperatur (və ya ilkin temperatur).
-
T2:
Buxar təzyiqinin bilinmədiyi/tapılmasını istədiyi temperatur (və ya son temperatur).
-
P1 və P2:
T1 və T2 temperaturlarında buxar təzyiqi.

Addım 2. Bildiyiniz dəyişənləri daxil edin
Clausius-Clapeyron tənliyi çox fərqli dəyişənlərə sahib olduğu üçün mürəkkəb görünür, amma doğru məlumatı əldə etsəniz əslində o qədər də çətin deyil. Əsas buxar təzyiqi problemlərində iki temperatur və bir təzyiq və ya iki təzyiq və bir temperatur dəyərləri veriləcək - anladığınız zaman bu tənliyi həll etmək çox asandır.
- Məsələn, 295 K -da buxar təzyiqi 1 atmosfer (atm) olan bir maye dolu bir qabımız olduğunu söylədiyimizi söyləyin. Sualımız budur: 393 K buxar təzyiqi nədir? İki temperatur və bir təzyiq dəyərimiz var, buna görə Clausius-Clapeyron tənliyindən istifadə edərək digər təzyiq dəyərlərini tapa bilərik. Dəyişənlərimizi bağlayaraq əldə edirik ln (1/P2) = (ΔHbuxar/R) ((1/393) - (1/295)).
- Qeyd edək ki, Clausius-Clapeyron tənliyi üçün həmişə temperatur dəyərindən istifadə etməlisiniz Kelvin. P1 və P2 dəyərləri eyni olduğu müddətdə istənilən təzyiq dəyərindən istifadə edə bilərsiniz.

Addım 3. Sabitlərinizi daxil edin
Clausius-Clapeyron tənliyinin iki sabit var: R və Hbuxar. R həmişə 8.314 J/(K × Mol) bərabərdir. Lakin, H.buxar (buxarlanma entalpiyası) buxar təzyiqi axtardığınız maddədən asılıdır. Yuxarıda qeyd edildiyi kimi, ümumiyyətlə H dəyərlərini tapa bilərsinizbuxar kimya və ya fizika dərsliyinin arxasındakı və ya internetdəki müxtəlif maddələr üçün (məsələn, burada.)
-
Misalımızda, mayemizin olduğunu düşünək təmiz su.
Cədvəldə H dəyərlərinə baxsaqbuxar, tapırıq ki, H.buxar təmiz su təxminən 40,65 KJ/mol təşkil edir. H dəyərimiz kilojoullarda deyil, joullarda olduğu üçün onu çevirə bilərik 40,650 J/mol.
- Sabitlərimizi bağlayaraq əldə edirik ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295)).
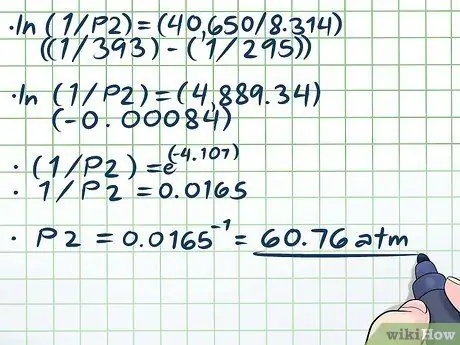
Addım 4. Tənliyi həll edin
Axtardığınızdan başqa bütün dəyişənləri tənliyə daxil etdikdən sonra tənliyi adi cəbr qaydalarına uyğun olaraq həll etməyə davam edin.
-
Tənlikimizi həll etməyin yeganə çətin hissəsi (ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))) təbii günlüyü həll edir (ln). Təbii logı çıxarmaq üçün tənliyin hər iki tərəfini riyazi sabitin göstəriciləri olaraq istifadə etmək kifayətdir. Başqa sözlə, ln (x) = 2 → eln (x) = e2 → x = e2.
- İndi tənliyimizi həll edək:
- ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = e(-4, 107)
- 1/P2 = 0.0165
-
P2 = 0.0165-1 = 60, 76 atm.
Bu məntiqlidir - qapalı bir konteynerdə, temperaturu demək olar ki, 100 dərəcəyə (qaynama nöqtəsindən 20 dərəcəyə qədər) qaldırmaq çoxlu buxar çıxararaq təzyiqi sürətlə artıracaq.
Metod 2 /3: Çözünmüş məhlulla buxar təzyiqinin tapılması
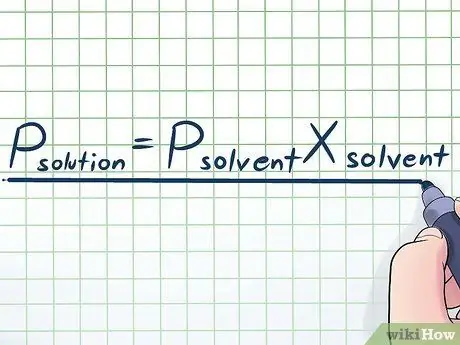
Addım 1. Raoult Qanununu yazın
Real həyatda nadir hallarda saf bir maye ilə işləyirik - adətən bir neçə fərqli maddənin qarışığı olan bir maye ilə işləyirik. Ən çox istifadə edilən qarışıqlardan bəziləri, həll etmək üçün bir həlledici adlanan bir çox kimyəvi maddələrdə az miqdarda müəyyən bir kimyəvi maddənin həll edilməsi yolu ilə hazırlanır. Bu hallarda, belə yazılan Raul Qanunu (fizik François-Marie Raoultun adını daşıyır) adlı bir tənliyi bilmək faydalıdır: Phəll= PhəllediciXhəlledici. Bu düsturda dəyişənlər;
-
Phəll:
Bütün məhlulun buxar təzyiqi (bütün elementləri birləşdirir)
-
Phəlledici:
Solvent buxar təzyiqi
-
Xhəlledici:
Solventin mol hissəsi
- Mole fraksiya kimi terminləri bilmirsinizsə narahat olmayın - bunları bir neçə addımda izah edəcəyik.

Addım 2. Solventinizi və həll etdiyiniz məhlulu təyin edin
Qarışıq bir mayenin buxar təzyiqini hesablamadan əvvəl istifadə etdiyiniz maddələri müəyyən etməlisiniz. Xatırladaq ki, bir həll bir həlledici içərisində həll edildikdə bir həll meydana gəlir - həll edən kimyəvi maddəyə həmişə həlledici, onu həll edən kimyəvi maddəyə isə həmişə həlledici deyilir.
- Müzakirə etdiyimiz anlayışları göstərmək üçün bu hissədəki sadə nümunələrdən istifadə edərək çalışaq. Bizim nümunəmiz üçün deyək ki, şəkər siropunun buxar təzyiqini tapmaq istəyirik. Ənənəvi olaraq, şəkər siropu suda həll olunan şəkərdir (1: 1 nisbətində), buna görə deyə bilərik şəkər həll etdiyimiz məhsuldur, su isə həlledicimizdir.
- Saxaroza (süfrə şəkəri) üçün kimyəvi düsturun C olduğunu unutmayın12H22O11. Bu kimyəvi formul çox əhəmiyyətli olacaq.
Addım 3. Solüsyonun temperaturunu tapın
Yuxarıdakı Clausius Clapeyron hissəsində gördüyümüz kimi, bir mayenin temperaturu buxar təzyiqinə təsir edəcək. Ümumiyyətlə, temperatur nə qədər yüksəkdirsə, buxar təzyiqi də bir o qədər yüksəkdir - temperatur yüksəldikcə daha çox maye buxarlanaraq buxar əmələ gətirərək konteynerdəki təzyiqi artırır.
Misalımızda, bu nöqtədə şəkər siropunun temperaturunun olduğunu söyləyək 298 K. (təxminən 25 C).
Addım 4. Solventin buxar təzyiqini tapın
Kimyəvi istinad materialları ümumiyyətlə çox istifadə olunan maddələr və birləşmələr üçün buxar təzyiqi dəyərlərinə malikdir, lakin bu təzyiq dəyərləri yalnız maddənin 25 C/298 K temperaturu və ya qaynama nöqtəsi olduğu halda etibarlıdır. Çözümünüzdə bu temperaturlardan biri varsa, bir istinad dəyərindən istifadə edə bilərsiniz, amma yoxsa bu temperaturda buxar təzyiqini tapmalısınız.
- Clausius -Clapeyron kömək edə bilər - müvafiq olaraq P1 və T1 üçün istinad buxar təzyiqi və 298 K (25 C) istifadə edin.
- Misalımızda, qarışığımızın temperaturu 25 C -dir, buna görə də asan istinad masamızı asanlıqla istifadə edə bilərik. 25 C -də suyun buxar təzyiqinin olduğunu bilirik 23.8 mm HG

Addım 5. Solventinizin mol hissəsini tapın
Bunu həll etməzdən əvvəl etməmiz lazım olan son şey həlledicimizin mol hissəsini tapmaqdır. Mole fraksiyasını tapmaq asandır: birləşmələrinizi mollara çevirin, sonra maddənin ümumi mol sayındakı hər bir birləşmənin faizini tapın. Başqa sözlə, hər bir birləşmənin mol payı bərabərdir (mürəkkəb mol)/(maddənin ümumi mol sayı).
-
Tutaq ki, şəkər siropu istifadə reseptimiz 1 litr (L) su və 1 litr saxaroza (şəkər).
Bu vəziyyətdə, hər bir birləşmənin mol sayını tapmalıyıq. Bunu etmək üçün hər bir maddənin kütləsini tapacağıq, sonra maddənin molar kütləsini mollara çevirmək üçün istifadə edəcəyik.
- Kütlə (1 L su): 1.000 qram (g)
- Kütlə (1 L çiğ şəkər): Təxminən 1,056, 8 g
- Mol (su): 1.000 qr × 1 mol/18.015 g = 55.51 mol
- Mol (saxaroza): 1,056, 7 qr × 1 mol/342,2965 g = 3,08 mol (unutmayın ki, saxarozanın molar kütləsini kimyəvi formulundan C tapa bilərsiniz.12H22O11.)
- Ümumi mollar: 55.51 + 3.08 = 58.59 mol
- Suyun mol payı: 55, 51/58, 59 = 0, 947
Addım 6. Bitirin
Nəhayət, Raoult Qanunu tənliyimizi həll etmək üçün lazım olan hər şeyə sahibik. Bu hissə çox asandır: bu hissənin əvvəlində sadələşdirilmiş Raoult Qanunu tənliyindəki dəyişənlər üçün dəyərlərinizi daxil edin (Phəll = PhəllediciXhəlledici).
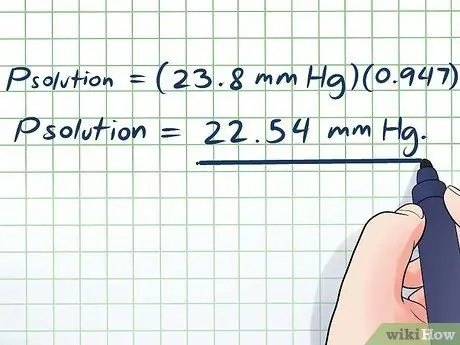
- Dəyərlərimizi daxil edərək əldə edirik:
- Phəll = (23,8 mm Hg) (0, 947)
-
Phəll = 22.54 mm Hg.
Nəticə məntiqlidir - mol baxımından çox miqdarda suda həll olunan şəkər çox azdır (baxmayaraq ki, real həyatda hər iki maddə eyni həcmdədir), buna görə də buxar təzyiqi yalnız bir qədər azalacaq.
Metod 3 /3: Xüsusi hallarda buxar təzyiqinin tapılması

Addım 1. Standart İstilik və Təzyiq şərtlərində diqqətli olun
Elm adamları tez-tez bir temperatur və təzyiq dəyərlərindən istifadə etmək asan bir "standart" olaraq istifadə edirlər. Bu dəyərlərə Standart Temperatur və Təzyiq (və ya STP) deyilir. Buxar təzyiqi problemləri tez -tez STP şərtlərinə aiddir, buna görə də bu dəyərləri xatırlamaq vacibdir. STP dəyərləri aşağıdakı kimi təyin olunur:
- Temperatur: 273, 15 K. / 0 C / 32 F
- Təzyiq: 760 mm civə sütunu / 1 atm / 101, 325 kilopaskal

Addım 2. Digər dəyişənləri tapmaq üçün Clausius-Clapeyron tənliyini yenidən təşkil edin
Birinci hissədəki nümunəmizdə Clausius -Clapeyron tənliyinin təmiz maddələr üçün buxar təzyiqini tapmaq üçün çox faydalı olduğunu gördük. Bununla birlikdə, bütün suallar P1 və ya P2 axtarmağınızı istəməyəcək - bir çoxları temperaturun dəyərini və ya hətta H dəyərini tapmağınızı xahiş edəcək.buxar. Xoşbəxtlikdən, bu hallarda, düzgün cavabı almaq, tənliyi həll etmək istədiyiniz dəyişənlərin bərabərlik işarəsinin bir tərəfində ayrı olması üçün yenidən təşkil etməkdir.
- Məsələn, 273 K -da 25 torr və 325 K -də 150 torr olan buxar təzyiqi bilinməyən bir mayemiz olduğunu söyləyin və bu mayenin buxarlanma entalpisini tapmaq istəyirik (ΔHbuxar). Bunu belə həll edə bilərik:
- ln (P1/P2) = (ΔHbuxar/R) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHbuxar/R)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hbuxar İndi dəyərlərimizi daxil edirik:
- 8, 314 J/(K × Mol) × (-1, 79)/(-0, 00059) = Hbuxar
- 8, 314 J/(K × Mol) × 3.033, 90 = Hbuxar = 25,223, 83 J/mol

Addım 3. Maddə buxar verdikdə həll olunan maddənin buxar təzyiqini hesablayın
Yuxarıdakı Raoult Qanunu nümunəmizdə, həll olunan şəkərimiz normal temperaturda öz -özünə heç bir təzyiq göstərmir (düşünün - üst dolabınızda sonuncu dəfə nə vaxt şəkər buxarlandığını gördünüz?) Lakin, həll olduğunuz zaman buxarlansanız, buxar təzyiqinizə təsir edər. Bunu Raoult Qanunu tənliyinin dəyişdirilmiş bir versiyasından istifadə edərək hesablayırıq: Phəll = (S.mürəkkəbXmürəkkəb) Sigma (Σ) simvolu, cavabımızı almaq üçün fərqli birləşmələrin bütün buxar təzyiqlərini əlavə etməyimiz lazım olduğunu bildirir.
- Məsələn, deyək ki, iki kimyəvi maddədən ibarət bir həllimiz var: benzol və toluol. Solüsyonun ümumi həcmi 12 mililitrdir (ml); 60 ml benzol və 60 ml toluol. Solüsyonun temperaturu 25 ° C -dir və 25 ° C -də bu kimyəvi maddələrin hər birinin buxar təzyiqləri benzol üçün 95.1 mm Hg və toluol üçün 28.4 mm Hg -dir. Bu dəyərlərlə məhlulun buxar təzyiqini tapın. Bunu iki kimyəvi maddə üçün standart sıxlıq, molar kütlə və buxar təzyiqi dəyərlərindən istifadə edərək aşağıdakı kimi edə bilərik:
- Kütlə (benzol): 60 ml = 0.060 L & dəfə 876.50 kq/1.000 L = 0.053 kq = 53 q
- Kütlə (toluol): 0.060 L & dəfə 866, 90 kq/1.000 L = 0.052 kq = 52 q
- Mol (benzol): 53 q × 1 mol/78, 11 g = 0.679 mol
- Mol (toluol): 52 g × 1 mol/92, 14 g = 0.564 mol
- Ümumi mollar: 0.679 + 0.564 = 1.243
- Mol fraksiyası (benzol): 0.679/1, 243 = 0.546
- Mole fraksiyası (toluol): 0.564/1, 243 = 0.454
- Həll yolu: P.həll = PbenzolXbenzol + PtoluolXtoluol
- Phəll = (95.1 mm Hg) (0, 546) + (28.4 mm Hg) (0, 454)
- Phəll = 51.92 mm civə sütunu + 12.89 mm civə sütunu = 64, 81 mm Hg
İpuçları
- Yuxarıdakı Clausius Clapeyron tənliyini istifadə etmək üçün temperatur Kelvinlə ölçülməlidir (K olaraq yazılır). Selsi temperaturunuz varsa, onu aşağıdakı düsturdan istifadə edərək çevirməlisiniz: Tk = 273 + Tc
- Yuxarıdakı üsullar istifadə edilə bilər, çünki enerji tətbiq olunan istilik miqdarı ilə tam mütənasibdir. Mayenin temperaturu buxar təzyiqinə təsir edən yeganə ekoloji faktordur.






